Este artigo faz parte de “Inovações em: doença de Alzheimer”Um relatório especial editorialmente independente que foi produzido com apoio financeiro a partir de Eisai.
UMA doença de Lzheimer provou ser um alvo complicado, e pesquisadores e desenvolvedores de drogas fazem tratamentos eficazes há décadas. Debata a raiva das causas subjacentes do distúrbio, e várias abordagens enfrentaram um obstáculo após o outro. Mas o campo atingiu um ponto de virada. Nos últimos quatro anos, a Food and Drug Administration aprovou várias terapias que abordam algumas das possíveis raízes biológicas da condição, em vez de apenas mitigar os sintomas – um marco científico -chave. Apesar dos avanços, no entanto, ainda há uma longa lista de perguntas abertas e muito trabalho a ser feito.
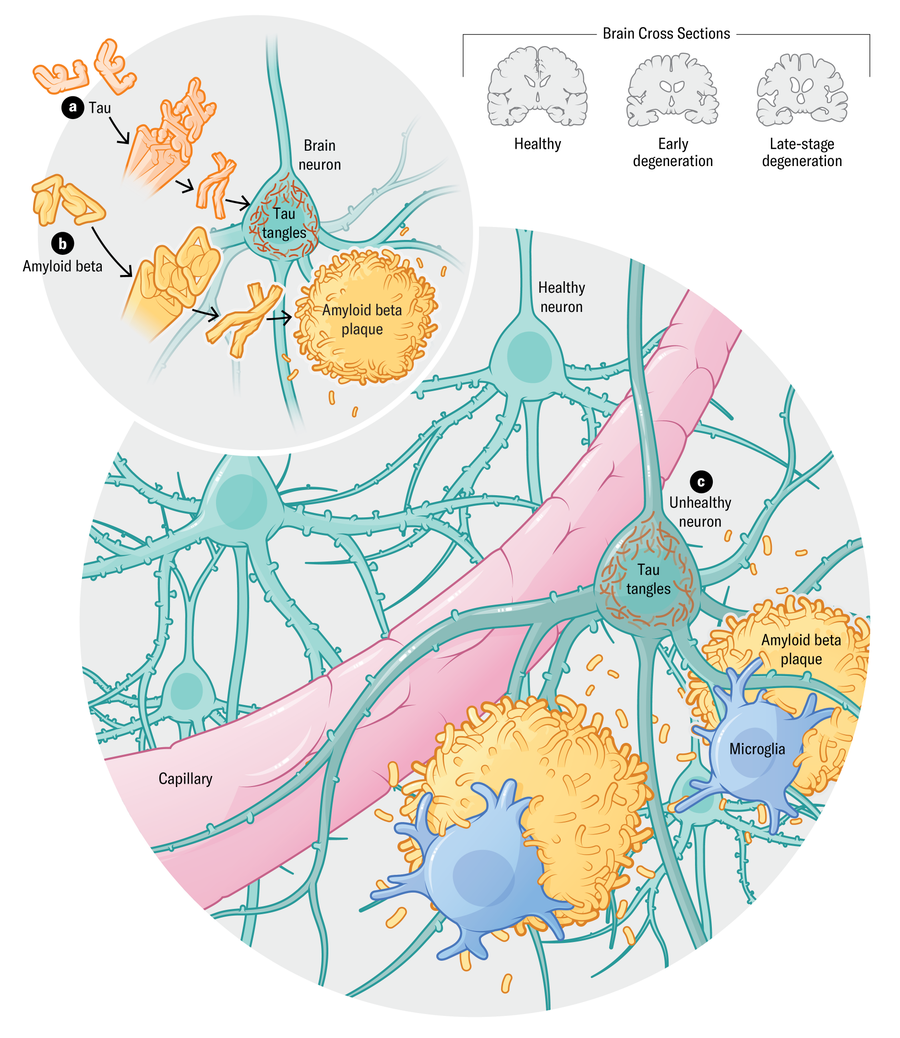
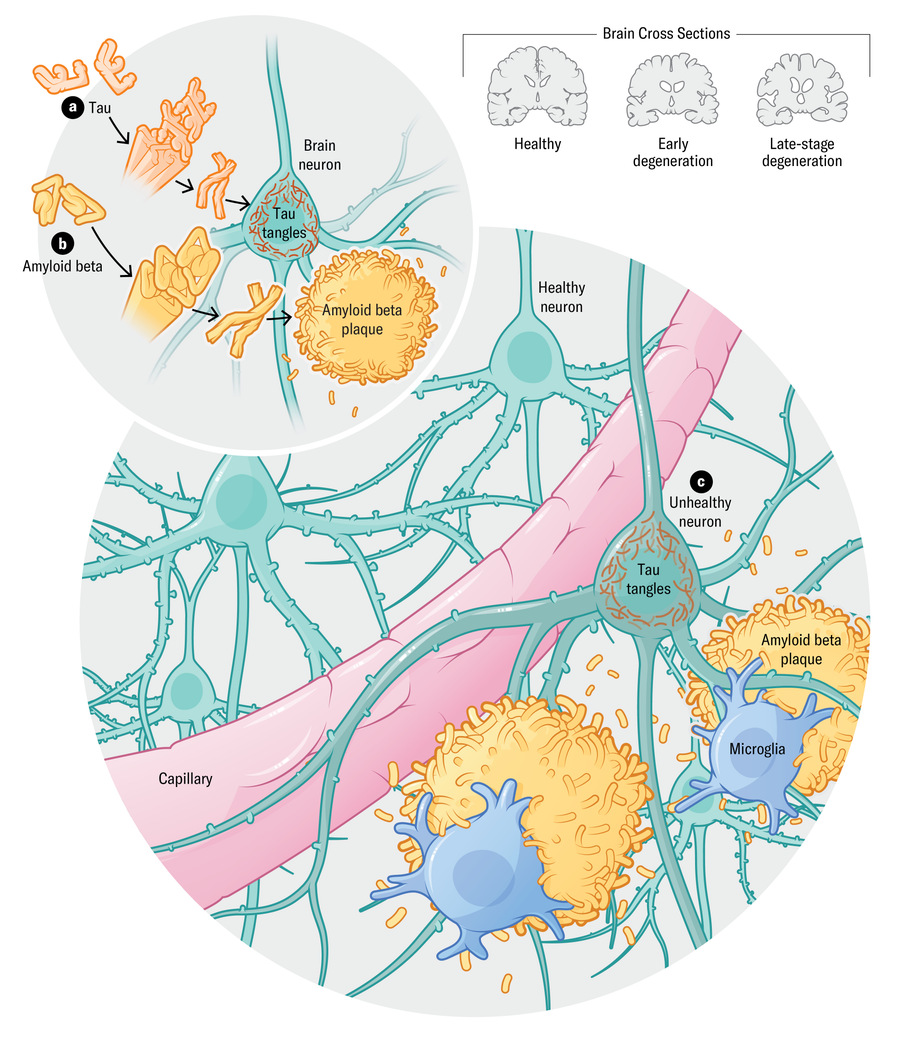
O cérebro de pessoas que morrem com Alzheimer mostram uma biologia distinta: aglomerados ou “placas” de proteínas beta amilóides em espaços entre neurônios e emaranhados de proteínas tau que se acumulam principalmente dentro das células nervosas. Uma teoria predominante sustenta que o amilóide se acumula cedo, e as emaranhadas tau se desenvolvem quando os danos às células nervosas estão em andamento, mas os sintomas cognitivos ainda não são aparentes. Com o tempo, essas proteínas patogênicas ou causadoras de doenças interrompem a comunicação de células nervosas. Os tratamentos mais recentes – Lecanemab e Donanemab – para proteínas beta amilóides, limpam -as do cérebro e diminuir modestamente lentamente o declínio cognitivo.
Sobre apoiar o jornalismo científico
Se você está gostando deste artigo, considere apoiar nosso jornalismo premiado por assinando. Ao comprar uma assinatura, você está ajudando a garantir o futuro das histórias impactantes sobre as descobertas e idéias que moldam nosso mundo hoje.
Mas a progressão das proteínas ligadas à doença para a demência real é longa e inexata, e as proteínas amilóides e tau se acumulam em pessoas com outros distúrbios neurodegenerativos também. Com o Alzheimer, muitas vezes existe um atraso de 20 a 30 anos entre a detecção inicial de um declínio cognitivo amilóide e óbvio. De acordo com um estudo que previu o risco de doenças baseado em dados demográficos, taxas de mortalidade e status de amilóide, menos de um quarto de mulheres cognitivamente saudáveis de 75 anos que testam positivas para amilóide em uma análise de líquido espinhal ou tomografia por emissão de pósitrons (PET) o varredura cerebral desenvolverá a demência de Alzheimer durante a vida. Tais descobertas sugerem que o amilóide por si só não está impulsionando a progressão da doença e estimulou os cientistas a investigar outras estratégias.
As análises de sequenciamento de DNA identificaram variantes de genes que influenciam o risco de Alzheimer. Alguns desses genes apontam para um papel crítico da atividade imunológica e da inflamação no processo da doença. Outras pesquisas indicam que uma maneira de reduzir o risco de doenças é através de mudanças no estilo de vida. De acordo com um relatório de 2024, quase metade dos casos de demência em todo o mundo pode ser evitada ou atrasada por ações que abordam 14 fatores de risco modificáveis, incluindo perda auditiva, inatividade física e fatores de risco vasculares, como diabetes e tabagismo (muitos dos quais também afetam a atividade imune e a inflamação).
O básico
Uma marca registrada bem conhecida da doença de Alzheimer é o acúmulo das proteínas Beta (A) e amilóide (B) no cérebro. Com o tempo, as placas e emaranhados causam danos aos neurônios (C) e morte celular. Mas a maioria dos pacientes de Alzheimer também acumulou outras proteínas, como alfa-sinucleína, bem como danos nos vasos sanguíneos que podem aparecer antes das placas amilóides. Evidências recentes sugerem que a inflamação, os processos imunológicos e os fatores de risco vasculares também desempenham um papel fundamental na doença.
Metas de tratamento
Existem mais de 100 ensaios clínicos em andamento testando uma variedade de intervenções, cada uma das quais tem como alvo um ou mais contribuidores em potencial para a demência. “Vamos chegar lá em etapas”, diz Sudha Seshadri, neurologista e diretor fundador do Instituto Glenn Biggs de Alzheimer e doenças neurodegenerativas na UT Health San Antonio, no Texas. “Os tratamentos para baixar amilóides são um pedaço. Também será importante controlar o risco vascular, acrescenta ela, o que “é importante, independentemente do que mais está acontecendo”.
Os mecanismos listados aqui são considerados elementos -chave do risco de Alzheimer:
Receptores de neurotransmissores • Proteínas nas superfícies de células nervosas que recebem sinais e desempenham um papel crítico na memória e na aprendizagem. Alguns medicamentos para a atividade prejudicial de Alzheimer nesses receptores, e outros aumentam a atividade, impedindo a quebra dos neurotransmissores.
Amilóide • Uma proteína que, quando dobrada, pode se acumular fora das células nervosas no cérebro e formar placas que perturbam a função neural. Várias terapias visam dissolver esses depósitos.
Inflamação e processos imunológicos • Estes podem ser ativados pelo acúmulo de formas anormais de amilóide e tau no cérebro, levando a danos às células nervosas e declínio cognitivo.
Tau • Uma proteína que normalmente ajuda a manter a estrutura e a forma de uma célula. Ele pode se acumular dentro dos neurônios e formar emaranhados, que são uma marca registrada da Alzheimer, junto com as placas amilóides. Algumas novas terapias tentam atingir formas patológicas de tau, impedindo a agregação dessas proteínas e aumentando sua liberação.
Plasticidade sináptica e neuroproteção • Maneiras pelas quais o cérebro modifica as conexões entre os neurônios durante o aprendizado e a memória e protege os neurônios contra danos. Ambos os processos podem ser interrompidos em pessoas com Alzheimer.
Metabolismo • O processo pelo qual o cérebro quebra os nutrientes. Nos pacientes de Alzheimer, os exames de PET mostram metabolismo anormalmente baixo de glicose em áreas cerebrais importantes para a memória e a cognição. Algumas terapias visam aumentar o metabolismo da glicose, que o cérebro precisa de energia.
Vasculatura • Os vasos sanguíneos especializados no cérebro formam uma interface dinâmica conhecida como barreira hematoencefálica, que ajuda a fornecer nutrientes às células nervosas e proteger o cérebro de patógenos. A quebra dessa barreira tem sido associada a múltiplas doenças neurodegenerativas, incluindo a de Alzheimer.
Fatores de crescimento e hormônios • Proteínas que podem proteger as células cerebrais de danos e estimular a produção de novas células. Algumas terapias visam reabastecê -las e fornecer uma camada extra de proteção.
Reguladores epigenéticos • Proteínas e outras moléculas que ligam ou desligam um gene sem alterar a sequência de DNA subjacente. Ao fazer isso, eles podem influenciar o acúmulo de tau amilóide dobrado, indoldado ou outras proteínas patogênicas.
Neurogênese • Crescimento neural. As células nervosas danificadas podem contribuir para o comprometimento da memória e o declínio cognitivo em pessoas com Alzheimer. A promoção do crescimento de novas células nervosas pode ajudar a diminuir esse declínio.
Estresse oxidativo • Uma superabundância prejudicial de radicais livres em relação aos antioxidantes no corpo, que pode prejudicar as células nervosas e interromper sua função. Algumas terapias visam aliviar os danos oxidativos, aumentando a atividade de enzimas específicas que neutralizam os radicais livres.
Proteostase • Um processo que mantém dobragem de proteínas, síntese e degradação adequadas nas células e pode ficar prejudicada em pessoas com Alzheimer. Algumas intervenções experimentais promovem vias celulares que evitam proteínas mal dobradas ou que facilitam sua remoção.
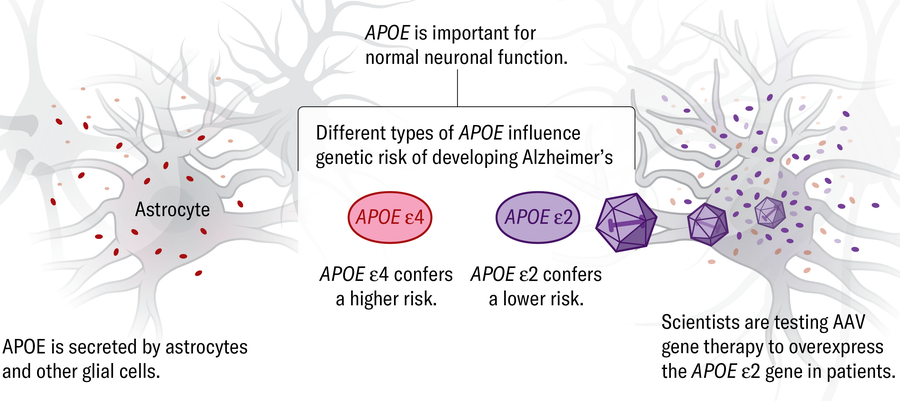
ApoE • Abreviação da apolipoproteína E, um gene que codifica proteínas que possui três formas principais: ε2, ε3 e ε4. ApoE ε4 é o fator de risco genético mais forte para a de Alzheimer. As pessoas têm duas cópias, ou alelos, de ApoE. Tendo um ApoE ε4 alelo pode aumentar o risco de doença de alguém em até quatro vezes o de pessoas com duas cópias da variante mais comum, ApoE ε3; dois ApoE Os alelos ε4 podem aumentar o risco até 25 vezes. Pessoas com dois ApoE Os alelos ε3 têm 40 % mais chances de desenvolver Alzheimer do que aqueles com um ε3 e um ε2.
Uma variedade de abordagens de drogas
Este gráfico inclui 138 medicamentos em 182 ensaios clínicos – os ensaios de Alzheimer farmacológicos registrados com ClinicalTrials.gov Em janeiro de 2025. Embora não seja abrangente (por exemplo, nem todos os ensaios baseados fora dos EUA estão incluídos), o conjunto de dados fornece uma visão útil de grande porte. (Nota do editor: os ensaios focados no exercício, estilo de vida ou intervenções de cuidador, terapias cognitivas comportamentais, suplementos, alimentos médicos ou terapias com células -tronco também não estão incluídas.) Os ensaios são agrupados de acordo com o mecanismo de ação compartilhado à esquerda (metas de tratamento) e objetivos terapêuticos à direita. Os gráficos de pizza mostram qual a porcentagem de cada categoria de medicamentos nos ensaios de Fase 1, Fase 2 e 3. (Os medicamentos nos ensaios da Fase 3 geralmente estão mais próximos da aprovação do FDA do que a Fase 1.) Receptores de neurotransmissores, amilóide e inflamação são atualmente os mecanismos mais direcionados. A categoria terapêutica mais popular são os medicamentos direcionados à doença-na qual o objetivo é diminuir o declínio clínico, concentrando-se em moléculas e sistemas corporais. Os medicamentos direcionados aos sintomas, por outro lado, têm como objetivo melhorar os sintomas mensuráveis que já estão presentes no início do tratamento.
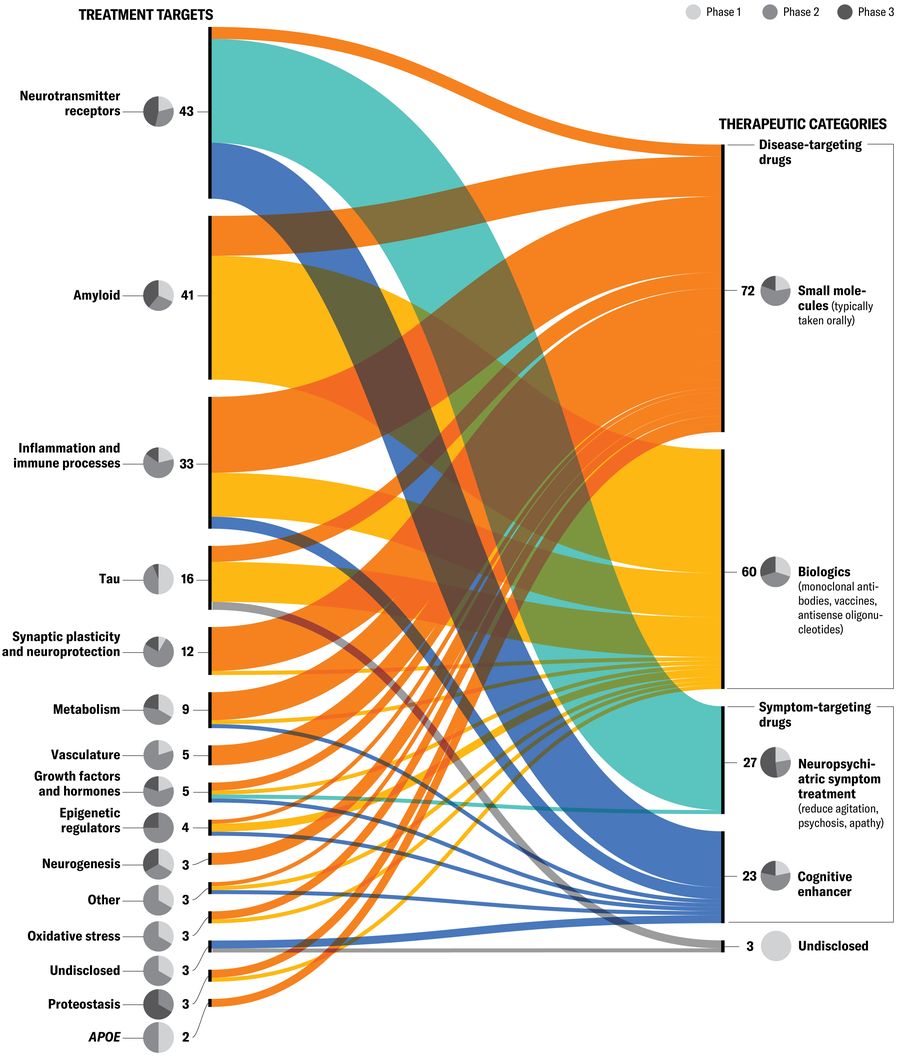
Jen Christiansen Fonte: “Pipeline de desenvolvimento de medicamentos para doença de Alzheimer: 2025”, de Jeffrey L. Cummings et al., Em Alzheimer e demência: pesquisa translacional e intervenções clínicasVol. 11; Abril a junho de 2025 (dados)
Estudos de caso de intervenção
Enquanto os medicamentos que têm como alvo as proteínas amilóides e tau receberam forte atenção e financiamento, outras abordagens terapêuticas se concentraram em outros mecanismos biológicos na doença de Alzheimer. Exemplos do último grupo estão descritos abaixo.
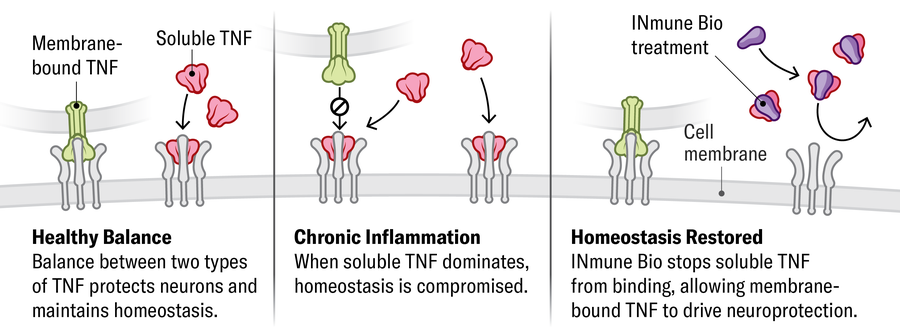
Inflamação • Manter as células nervosas saudáveis e protegê-las de danos requer equilíbrio entre formas solúveis e ligadas à membrana de uma proteína chamada TNF-α. Em condições de disfunção imunológica, um aumento no TNF-α solúvel interrompe o equilíbrio saudável, ou a homeostase, e aumenta a inflamação. Uma empresa (Inmune Bio) está desenvolvendo um medicamento que se liga e desativa o TNF-α solúvel, restaurando os efeitos promotores de saúde da forma transmembranar.
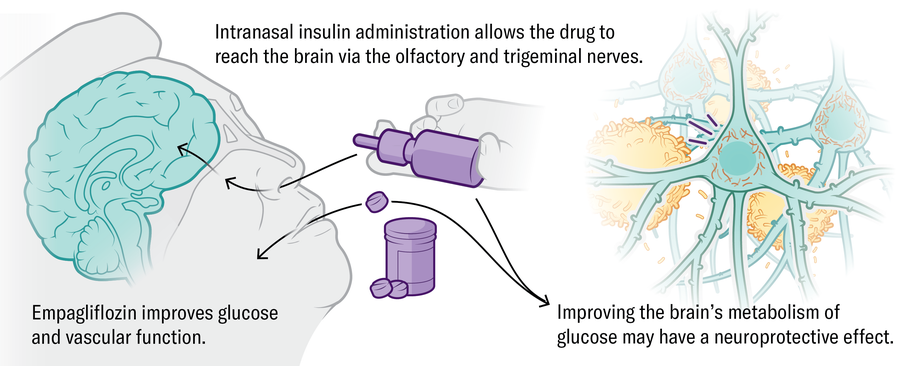
Metabolismo • A insulina, um hormônio que regula a disponibilidade de energia e a comunicação das células cerebrais, também ajuda a manter a saúde imunológica e vascular. Um ensaio clínico liderado por Suzanne Craft da Wake Forest University School of Medicine está testando a entrega intranasal de insulina e a empolflozina de medicamentos para diabetes em pessoas com o comprometimento cognitivo de Alzheimer.
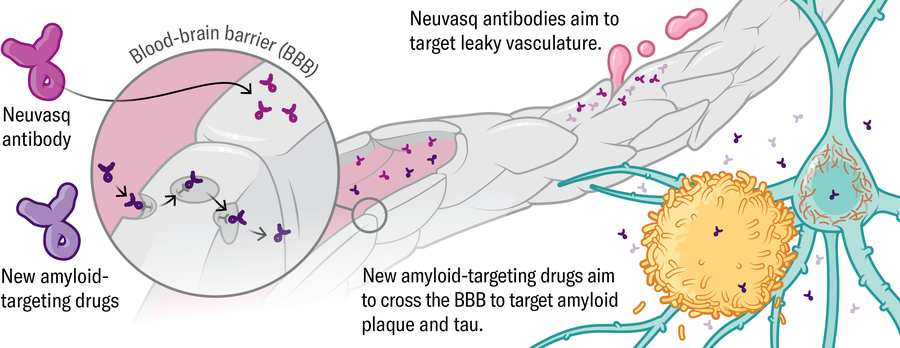
Vasculatura • Várias empresas estão desenvolvendo novas versões de anticorpos amilóides que podem penetrar no cérebro com mais eficácia – por exemplo, o Trontinemab da Roche. Pelo menos uma empresa, Neuvasq, está desenvolvendo uma intervenção em estágio anterior que tem como alvo a própria vasculatura, para testar se uma barreira hematoencefálica menos com vazamento poderia diminuir a progressão da doença.
ApoE • Algumas estratégias terapêuticas visam reduzir ou se livrar do ApoE variante de risco ε4, aumente a produção de proteínas pela forma de gene protetora, ApoE ε2, ou editar o ApoE ε4 gene para o ApoE ε2 versão. Em um pequeno estudo de terapia genética, a Lexeo Therapeutics usou vírus modificados para entregar o ApoE ε2 gene no líquido espinhal de 15 pacientes de Alzheimer que tinham o mais perigoso ApoE ε4 variante.