‘Blink e você sentirá falta’ é um eufemismo no mundo da biologia de proteínas. Um piscar dura centenas de milissegundos. As proteínas operam em uma escala de tempo muito mais curta – da ordem de um milissegundo, ou ainda mais rápido. “Para capturar muitos dos movimentos de domínio das proteínas que estão ligadas à função, você teria que ser capaz de ir a uma escala de tempo de microssegundos”, diz Ulrich Lorenz, químico do Instituto Federal de Tecnologia da Suíça em Lausanne.
Trabalhar nessa escala de tempo há biólogos há muito tempo, mas a rápida evolução da microscopia crio-eletrônica resolvida no tempo (TR crio-EM) nos últimos anos tornou possível reconstruir processos dinâmicos com detalhes quase atômicos.
Como os medicamentos para escudas de proteínas poderiam vencer alguns dos cânceres mais cruéis
Além das idéias biológicas fundamentais, uma compreensão mais profunda da dinâmica de proteínas pode orientar o desenvolvimento de medicamentos mais eficazes e aumentar os esforços de engenharia de proteínas. “O crio-EM resolvido no tempo pode ser a escolha natural-ou apenas opção-para capturar conformações (proteínas) que podem ser potencialmente mais alvo de drogas”, diz Youdong Mao, físico da Universidade de Pequim em Pequim, China.
Mas a técnica é nicho: esses métodos requerem experiência considerável e equipamentos especializados, e os pesquisadores ainda estão descobrindo como interpretar os dados resultantes. “A natureza não tem nenhuma obrigação de ser simples”, adverte a Radoslav Enchev, bioquímica do Francis Crick Institute, em Londres. E até que mais laboratórios obtenham as ferramentas necessárias para executar o TR crio-EM, o progresso neste campo emocionante continuará sendo esporádico.
De fotos à cinematografia
O básico do crio-EM é direto: os pesquisadores aplicam soluções de proteínas a um substrato ‘grade’ e as congelam em uma estrutura vítrea conhecida como gelo vítreo. Usando um microscópio eletrônico de transmissão, eles depois imaginam moléculas individuais em muitas orientações – imagine pedaços de frutas embutidos em geléia. Dados exemplos suficientes, essas ‘projeções’ 2D podem ser reconstruídas em uma estrutura 3D de alta resolução.
Usuários qualificados podem produzir estruturas nítidas o suficiente para resolver átomos individuais de hidrogênio. Mas a maioria das experiências imagem é uma única conformação relativamente estável. O biólogo estrutural Stephen Muench, na Universidade de Leeds, no Reino Unido, lutou por anos com as limitações de seus estudos crio-EM de uma proteína conhecida como ATPase vacuolar, um motor molecular que gira à medida que bombeia prótons entre as membranas lipídicas. “Havia muitas perguntas que simplesmente não podíamos responder com estruturas estáticas”, diz Muench.
De maneira mais geral, diz Lorenz, os biólogos tiveram que escolher se devem atingir alta resolução no tempo ou no espaço. Os experimentos de ‘super-resolução’ de células vivas podem visualizar proteínas únicas em escalas de tempo de milissegundos, mas não podem discernir características estruturais detalhadas. A ressonância magnética nuclear pode registrar transições relativamente rápidas entre as conformações de proteínas com alta resolução, mas é limitada a pequenos alvos. E embora a cristalografia de raios-X resolvida no tempo possa distinguir os detalhes atômicos e o movimento incrivelmente rápido, em escala de femtossegundos, isso o faz em um ambiente altamente restrito. “A dinâmica de proteínas não ocorre naturalmente em um cristal”, explica Lorenz.

Esses ‘filmes’ de proteínas em ação estão revelando a biologia oculta das células
Em princípio, o Cryo-EM fornece um excelente ajuste para experimentos resolvidos no tempo. Dadas partículas suficientes, os pesquisadores poderiam teoricamente reconstruir todo estado conformacional que uma proteína pode assumir. O truque é fazer com que esses processos dinâmicos se desenrolem no bloqueio, de modo que as reconstruções 3D possam ser montadas em um filme molecular. Isso pode ser conseguido tomando uma amostra de proteína em equilíbrio, introduzindo um ligante ou outro gatilho molecular que inicia o movimento e, em seguida, congelando rapidamente a amostra em vários momentos após o início da reação.
Em 1995, por exemplo, Nigel Unwin, um biólogo estrutural do Laboratório MRC de Biologia Molecular em Cambridge, Reino Unido, preparou uma grade com o receptor para o neurotransmissor acetilcolina e pulverizou com uma solução contendo acetilcolina1. Ao congelar rapidamente a mistura, Unwin capturou alterações que ocorreram no receptor dentro de cinco milissegundos da ligação da acetilcolina. A resolução espacial crio-EM era ruim naqueles dias, mas outros grupos aproveitaram posteriormente as abordagens semelhantes ‘spray e mistura’ para produzir reconstruções dinâmicas detalhadas com instrumentos modernos e de alta resolução.
No entanto, os métodos de pulverização e mistura também podem introduzir incerteza considerável devido à mistura ineficiente entre proteínas e ligantes. “A difusão está acontecendo, então nada está realmente sob controle”, diz Joachim Frank, biofísico da Universidade de Columbia, em Nova York, que compartilhou o Prêmio Nobel de 2017 em química por seu papel fundamental no avanço do crio-EM pela biologia estrutural. “Queríamos desenvolver um método no qual tenhamos controle de tudo”.
Como alternativa, o grupo de Frank começou a trabalhar em chips microfluídicos baseados em polímeros, contendo pequenos canais, dentro dos quais uma proteína e seu ligante podem ser misturados com precisão antes de ser pulverizados em uma grade e congelado. Eles descreveram seu instrumento de primeira geração em 20152e vários outros grupos posteriormente criaram sistemas alternativos ‘Mix and Spray’.
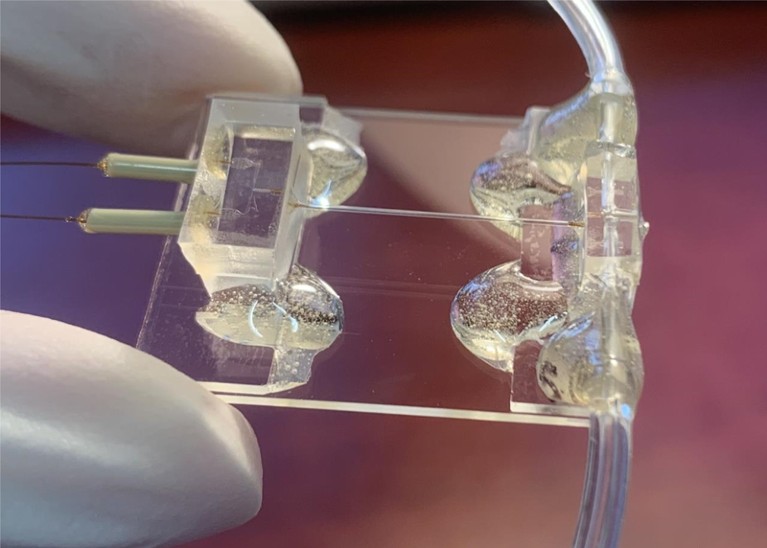
Um chip microfluídico compreendendo três partes: um micromixer, um micro -reator e um micro -pulverizador.Crédito: S. Bhattacharjee et al./Célula
Os chips contemporâneos incorporam canais de zigue-zagueas com precisão para mistura rápida e eficiente da amostra e fluxo de fluido suave, e a mistura e a spray se tornaram o método de escolha para muitos praticantes de crio-EM TR. No ano passado, por exemplo, Frank e seus colegas usaram seu projeto microfluídico de última geração para estudar como os ribossomos são reciclados após a síntese de proteínas para iniciar a tradução de uma nova cadeia de polipeptídeos3. “Podemos ver como o ribossomo é aberto como uma casca de molusco após a interação com uma molécula específica que leva a coisa toda aberta”, diz Frank. Em abril, Muench e seus colaboradores empregaram seu próprio sistema de mistura e spray para estudar complexos de actomiosina de fibras musculares, revelando detalhes cruciais sobre como a proteína miosina armazena e posteriormente libera a energia que alimenta a contração muscular ao longo de 120 milissegundos4.
Ainda assim, há muito espaço para melhorias. Por um lado, a preparação da amostra baseada em microfluídica requer muito material. “Ao congelar um momento, você consome vários microlitros de amostra, que normalmente é toda a proteína que você pode purificar ao longo de vários meses”, diz Mao. Sua equipe seguiu uma abordagem alternativa para estudar o complexo de proteasoma degradador de proteínas, usando condições de reação que diminuíram a atividade do proteassoma para um rastreamento para que dados resolvidos no tempo pudessem ser coletados usando métodos crio-EM mais convencionais.
Uma paisagem em evolução
Pesquisadores liderados por Rouslan Efremov, um biólogo estrutural do Centro VIB-Vub de Biologia Estrutural em Bruxelas, criaram um sistema de mistura e pulverização que reduz os requisitos de tamanho de amostra por uma ordem de magnitude. Seu dispositivo microfluídico mistura uma proteína e um ligante em gotículas minúsculas, permitindo que elas reagem rapidamente em um espaço confinado antes de serem lançadas na grade usando um mecanismo baseado em laser5. “A principal vantagem é que isso consome apenas cerca de 100 nanolitres por grade”, diz Efremov, que usou essa abordagem para estudar complexos responsáveis pelo dobramento de proteínas e metabolismo bacteriano.
As taxas de quadros mais rápidas também estão em demanda. As abordagens microfluídicas existentes têm um ‘limite de velocidade’ de cerca de 5 milissegundos e, embora muitas mudanças conformacionais ocorram nesse período, outras não. Além disso, a resolução em escala de milissegundos captura preferencialmente os principais intermediários e pontos finais para uma mudança conformacional de proteínas, mas perde os estados de transição de vida mais curta que são essenciais para entender os eventos que antecederam essa mudança.
Captura de proteínas em jogo: o método revelando os mistérios internos da célula
O grupo de Lorenz fez uma aposta em sua tentativa de quebrar a barreira milissegundosa6. Primeiro, os pesquisadores congelam sua amostra de proteínas em uma grade na presença de um ligante ou ativador inativo e quimicamente “enjaulado”. A amostra congelada é então iluminada com um laser para liberar o composto ativador, após o qual um segundo feixe é usado para derreter rapidamente o gelo. Após um intervalo apropriado, a amostra é rapidamente recrontada, capturando alterações conformacionais que ocorrem em apenas 5 microssegundos.
Notavelmente, essa estratégia de fusão e revitrificação parece não afetar negativamente as proteínas, e Lorenz observa que pode até melhorar a resolução da reconstrução 3D batendo as partículas de proteína em uma ampla gama de orientações. Sua equipe está atualmente usando esse método para estudar uma variedade de vírus e investigar como as mudanças conformacionais rápidas das proteínas virais ajudam a infecção por células hospedeiras. E instantâneos ainda mais rápidos podem estar ao alcance. “Acho que 10 nanossegundos ou mais devem ser facilmente possíveis”, diz Lorenz, acrescentando que essa resolução pode capturar eventos ultra-rápidos, como a dobragem de domínios estruturais proteicos.
Quando se trata de TR Cryo-EM, até pequenos detalhes são importantes. Por exemplo, a camada de gelo na grade precisa ser espessa o suficiente para proteger as proteínas do ar, o que pode danificar as moléculas e torná -las ininterpretáveis, mas também finas o suficiente para maximizar o contraste da imagem. Em uma pré -impressão publicada em abril, Enchev e seus colegas apresentaram uma plataforma chamada Chronobot para resolver esse problema7. Aqui, as amostras são misturadas em um chip microfluídico de vidro reutilizáveis e depois pulverizadas na grade, que é fotografada com uma câmera de alta velocidade imediatamente antes de zero. Um algoritmo de aprendizado profundo avalia a qualidade do gelo em cada setor da grade, além de otimizar futuras condições de preparação de amostras com base nesses resultados. Isso ajuda a equipe a evitar desperdiçar tempo valioso do instrumento em amostras ruins. “Essa iteração rápida longe do microscópio caro nos permite garantir que tenhamos um conjunto de dados de alta resolução de qualquer grade que passe esse controle de qualidade”, diz Enchev.



